Migracja – zjawisko nie tylko dobre
Ruchliwość komórek jest niezbędna dla funkcjonowania organizmu: dzięki niej goją się rany, działają mechanizmy odpornościowe, rozwija się zarodek (Alberts i in., 2016). Komórki poruszają się, korzystając z dynamicznych zmian w cytoszkielecie, szczególnie aktynowym – sieci białek, która buduje ich „szkielet ruchu” (Lee i Dominguez, 2010).
Ale migracja może też działać na niekorzyść organizmu, gdy zostaje uruchomiona w komórkach nowotworowych. Te wykorzystują naturalne mechanizmy ruchu, aby rozprzestrzeniać się, naciekać tkanki i tworzyć przerzuty (Kłopocka i Barańska, 2005).
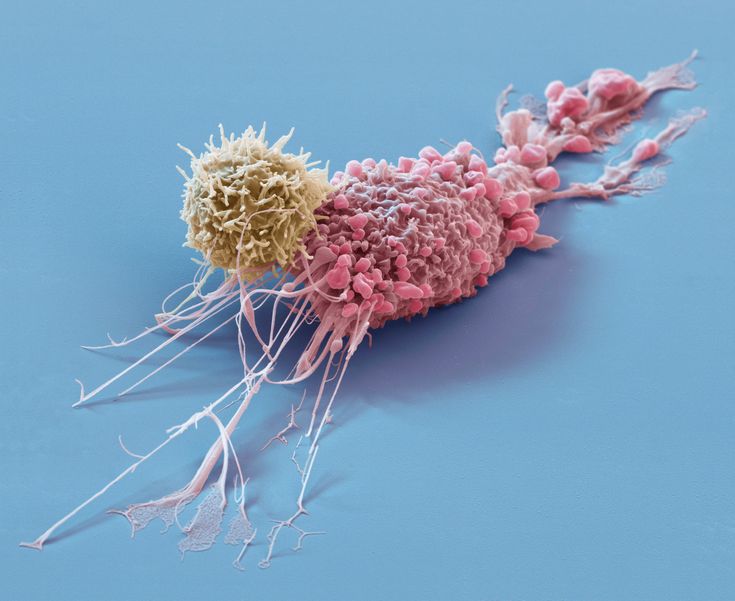
Co umożliwia ruch komórki?
Aby komórka mogła się poruszyć, musi najpierw zbudować asymetrię – przód i tył, funkcjonalnie różne. Przód (lamellipodium) „ciągnie” komórkę w stronę bodźca, tył zaś się kurczy i odrywa od podłoża (Pollard, 2016). To wszystko zależy od ciągłej przebudowy filamentów aktynowych, kontrolowanych przez białka wiążące aktynę (ABP), receptory błonowe i szlaki sygnałowe (Lee i Dominguez, 2010).
Komórki nowotworowe przejmują tę samą maszynerię ruchu, ale wykorzystują ją do inwazji – np. przez błony podstawne do naczyń krwionośnych – i tworzenia ognisk przerzutowych (Bagchi i in., 2005).
Receptor P2Y2 – nie tylko neuroprotekcja
Receptor P2Y2 to metabotropowy receptor aktywowany przez nukleotydy (ATP i UTP). W zdrowych komórkach glejowych bierze udział w regeneracji i migracji do miejsc uszkodzenia (Kłopocka i Korczyński, 2014). Te same mechanizmy mogą jednak zostać przejęte przez komórki nowotworowe, takie jak glejaki, które wykorzystują je do ekspansji (Kłopocka, Korczyński i Pomorski, 2013).
Modelowym układem badawczym są komórki glejaka C6, w których dobrze widać, jak aktywacja P2Y2 przekłada się na ruchliwość i inwazyjność komórki (Weisman i in., 2012).
Integryny, Rac i Rho – wspólnicy migracji
Receptor P2Y2 nie działa sam. Współpracuje z innymi białkami błonowymi, jak integryny αvβ3 i αvβ5, które przyczepiają komórkę do podłoża i pomagają regulować sygnały mechaniczne (Wang i in., 2005). Gdy P2Y2 zostanie aktywowany przez UTP, oddziałuje z integrynami i uruchamia kaskady sygnałowe przez białka Rac i Rho – dwa kluczowe regulatorzy cytoszkieletu aktynowego (Kłopocka i Korczyński, 2014).
- Rac odpowiada za rozbudowę lamellipodiów,
- Rho – za kurczenie tylnej części komórki (Kłopocka i Barańska, 2005).
To „molekularna drużyna” do migracji – komórki nowotworowe wykorzystują ją, by przemieszczać się i unikać działania terapii.
Kofilina – enzym, który tnie i uwalnia
Jednym z końcowych efektorów tych szlaków jest kofilina – białko, które przecina filamenty aktynowe i umożliwia ich dynamiczną przebudowę (Ostrowska i Moraczewska, 2017). Komórki nowotworowe „uczą się” manipulować aktywnością kofiliny, by szybciej reorganizować cytoszkielet i przystosowywać się do mikrośrodowiska.
Regulacja kofiliny odbywa się przez kinazy LIM (LIMK1, LIMK2) oraz fosfatazy SSH – oba mechanizmy są aktywowane przez sygnały z P2Y2 (Prunier i in., 2017). Nadaktywność kinaz LIM, zaobserwowana w niektórych nowotworach, prowadzi do utrzymania kofiliny w stanie nieaktywnym lub do niekontrolowanego „cięcia” (Kłopocka i Korczyński, 2014).
Podwójna natura sygnałów
Te same szlaki, które mogą wspierać regenerację w układzie nerwowym, są też odpowiedzialne za rozrost nowotworów(Weisman i in., 2012). Receptor P2Y2 okazuje się mieczem obosiecznym – pełniąc rolę zarówno w neuroprotekcji, jak i neurodegeneracji i nowotworzeniu, w zależności od kontekstu komórkowego.
Dlatego tak wiele badań koncentruje się dziś na P2Y2 jako potencjalnym celu terapeutycznym – który można wyciszyć w nowotworach, a pobudzić w regeneracji tkanek (Bagchi i in., 2005; Weisman i in., 2012).
Literatura cytowana
Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M. i Walter, P. (2016). Podstawy biologii komórki. Warszawa: Wydawnictwo Naukowe PWN.
Bagchi, S., Liao, Z., Gonzalez, F. A., Chorna, N. E., Seye, C. I., Weisman, G. A. i Erb, L. (2005). The P2Y2 nucleotide receptor interacts with αv integrins to activate Go and induce cell migration. Journal of Biological Chemistry, 280(47), 39050–39057. https://doi.org/10.1074/jbc.M504670200
Kłopocka, W. i Barańska, J. (2005). Rola białek z rodziny Rho w kontroli migracji komórek pełzających. Postępy Biochemii, 51(1), 36–43.
Kłopocka, W. i Korczyński, J. (2014). Receptory nukleotydowe a dynamika cytoszkieletu aktynowego. Postępy Biochemii, 60(4), 447–455.
Kłopocka, W., Korczyński, J. i Pomorski, P. (2013). Cytoskeleton and nucleotide signaling in glioma C6 cells. W: Weisman, G. A. (red.), Glioma Signaling, ss. 103–119.
Lee, S. H. i Dominguez, R. (2010). Regulation of actin cytoskeleton dynamics in cells. Molecules and Cells, 29(4), 311–325.
Ostrowska, Z. i Moraczewska, J. (2017). Kofilina – białko kontrolujące dynamikę filamentów aktynowych. Postępy Higieny i Medycyny Doświadczalnej, 71, 1–10.
Prunier, C., Prudent, R., Kapur, R., Sadoul, K. i Lafanechère, L. (2017). LIM kinases: cofilin and beyond. Oncotarget, 8(25), 41749.
Pollard, T. D. (2016). Actin and actin-binding proteins. Cold Spring Harbor Perspectives in Biology, 8(8), a018226.
Wang, M., Kong, Q., Gonzalez, F. A., Sun, G., Erb, L., Seye, C. i Weisman, G. A. (2005). P2Y2 nucleotide receptor interaction with αv integrin mediates astrocyte migration. Journal of Neurochemistry, 95(3), 630–640. https://doi.org/10.1111/j.1471-4159.2005.03393.x
Weisman, G. A., Camden, J. M., Peterson, T. S., Ajit, D., Woods, L. T. i Erb, L. (2012). P2 receptors for extracellular nucleotides in the central nervous system: role of P2X7 and P2Y2 receptor interactions in neuroinflammation. Molecular Neurobiology, 46(1), 96–113. https://doi.org/10.1007/s12035-012-8292-1

Odnośnik zwrotny: Sztuczna inteligencja w mammografii: czy AI przewyższa radiologów?