Dlaczego komórka nigdy nie stoi w miejscu?
Mimo że często wyobrażamy sobie komórki jako statyczne, żywe komórki są dynamiczne – zmieniają kształt, przemieszczają się, reorganizują swoje wnętrze (Alberts i in., 2016; Kilarski, 2012). W centrum tych procesów leży aktyna, jedno z najobficiej występujących białek w komórkach eukariotycznych (Dominguez i Holmes, 2011; Lee i Dominguez, 2010). To właśnie dzięki niej komórka potrafi nie tylko „poczuć” bodziec z otoczenia, ale i zareagować ruchem (Pollard, 2016).
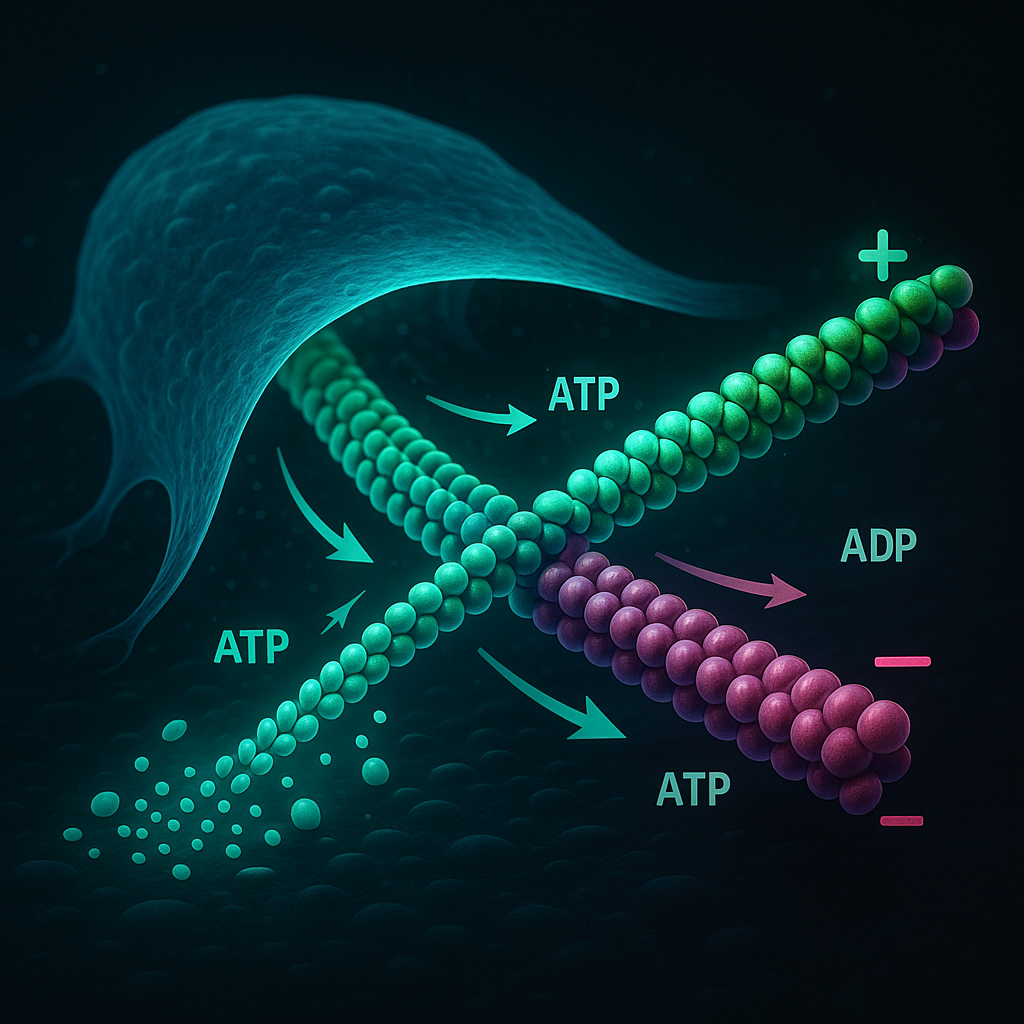
Treadmilling – białkowa taśma w ruchu
Jednym z najbardziej fascynujących zjawisk związanych z aktyną jest „treadmilling” – dynamiczna wymiana podjednostek aktynowych na dwóch końcach filamentu (Bugyi i Carlier, 2010; Narita, 2011). To jakby taśma białkowa, która nie przesuwa się fizycznie, ale zmienia swój skład tak, że wygląda, jakby się poruszała.
Polaryzacja – czyli aktyna z przodu i z tyłu
Każdy filament aktynowy ma dwa różne końce:
- koniec plus („kolczasty”) – to tutaj monomery G-aktyny są dołączane najintensywniej,
- koniec minus („ostry”) – tutaj zachodzi depolimeryzacja (Strzelecka-Gołaszewska, 2001; Narita i in., 2011).
Podczas treadmillingu monomery aktyny są dodawane na końcu plus, a odłączane z końca minus. Dzięki temu filament zachowuje stałą długość, ale w rzeczywistości stale się odnawia, co ma kluczowe znaczenie dla plastyczności cytoszkieletu.
Źródło energii? ATP!
Do każdego monomeru aktyny przyłączone jest ATP. Po włączeniu do filamentu następuje hydroliza ATP do ADP, a potem – wolniejsze – odłączenie ortofosforanu (Pi) (Pollard, 2016). W regionie końca plus aktyna związana z ATP jest bardziej stabilna – dlatego właśnie tam powstają nowe fragmenty filamentów (Narita i in., 2011; Bugyi i Carlier, 2010).
Ten cykl – ATP → ADP + Pi → ADP – napędza nieustanny przepływ aktyny w strukturach takich jak lamellipodia, umożliwiając komórce szybką odpowiedź na bodźce i ruch we właściwym kierunku (Narita, 2011; Alberts i in., 2016).
Regulacja przez białka wiążące aktynę
Treadmilling nie mógłby zachodzić bez pomocy wyspecjalizowanych białek wiążących aktynę (ABP) (Lee i Dominguez, 2010; Pollard, 2016):
- Profilina wiąże się z G-aktyną i promuje wymianę ADP na ATP, przygotowując ją do ponownego użycia.
- Tymozyna-β4 wiąże monomery i sekwestruje je, ograniczając ich dostępność (Strzelecka-Gołaszewska, 2001).
- Kofilina zwiększa depolimeryzację, przecinając filamenty zawierające ADP-aktynę (Bugyi i Carlier, 2010).
- Białka czapeczkujące (CP) blokują szybkorosnący koniec filamentu, zapobiegając jego niekontrolowanemu wydłużaniu (Stepień i in., 2006).
Dzięki tej sieci regulatorów komórka precyzyjnie steruje równowagą pomiędzy budową i rozkładem filamentów aktynowych.
Treadmilling – siła napędowa lamellipodium
W przedniej części migrującej komórki, tzw. lamellipodium, treadmilling osiąga największą intensywność (Stepień i in., 2006). Filamenty aktynowe „płyną” ku przodowi – nie przez przesunięcie, ale dzięki ciągłej wymianie monomerów.
To właśnie treadmilling, zasilany przez ATP i wspierany przez ABP, umożliwia komórce:
✔️ przesuwanie błony,
✔️ tworzenie punktów adhezji,
✔️ skracanie tylnych wypustek,
✔️ kierunkową migrację.
Patologiczne konsekwencje zaburzonego treadmillingu
Nadaktywność lub deregulacja białek kontrolujących treadmilling może prowadzić do zwiększonej ruchliwości komórek nowotworowych, które wykorzystują ten mechanizm do przerzutów (Pollard, 2016; Gross, 2013). Zmiany w cyklu aktyny mogą także odgrywać rolę w neurozapaleniu i chorobach neurodegeneracyjnych (Narita i in., 2011).
Literatura cytowana:
Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M. i Walter, P. (2016). Podstawy biologii komórki. Warszawa: Wydawnictwo Naukowe PWN.
Bugyi, B. i Carlier, M. F. (2010). Control of actin filament treadmilling in cell motility. Annual Review of Biophysics, 39, 449–470.
Dominguez, R. i Holmes, K. C. (2011). Actin structure and function. Annual Review of Biophysics, 40, 169–186.
Gross, S. R. (2013). Actin binding proteins: their ups and downs in metastatic life. Cell Adhesion & Migration, 7(2), 199–213.
Kilarski, W. M. (2012). Strukturalne podstawy biologii komórki. Warszawa: Wydawnictwo Naukowe PWN.
Lee, S. H. i Dominguez, R. (2010). Regulation of actin cytoskeleton dynamics in cells. Molecules and Cells, 29(4), 311–325.
Narita, A. (2011). Minimum requirements for the actin-like treadmilling motor system. Bioarchitecture, 1(5), 205–208.
Narita, A., Oda, T. i Maéda, Y. (2011). Structural basis for the slow dynamics of the actin filament pointed end. The EMBO Journal, 30(7), 1230–1237.
Pollard, T. D. (2016). Actin and actin-binding proteins. Cold Spring Harbor Perspectives in Biology, 8(8), a018226.
Strzelecka-Gołaszewska, H. (2001). Generacja ruchu przez polimeryzację aktyny. Kosmos, 50(4), 411–425.
Stępień, A., Grzanka, A. i Szpechciński, A. (2006). Struktury cytoszkieletu aktynowego formowane przy krawędzi wiodącej komórki podczas pierwszego etapu migracji. Postępy Biologii Komórki, 33(2), 381–392.
